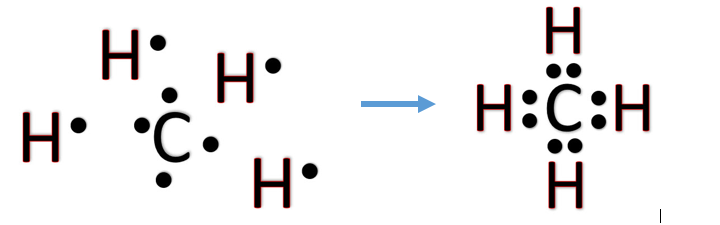La démocratie a parlé #IWonTheElection, voici donc comme promis le thread qui expliquera pourquoi il y a intérêt à se lever tôt pour essayer de virer le #CO2 de l’atmosphère #Climat #UrgenceClimatique 1/n
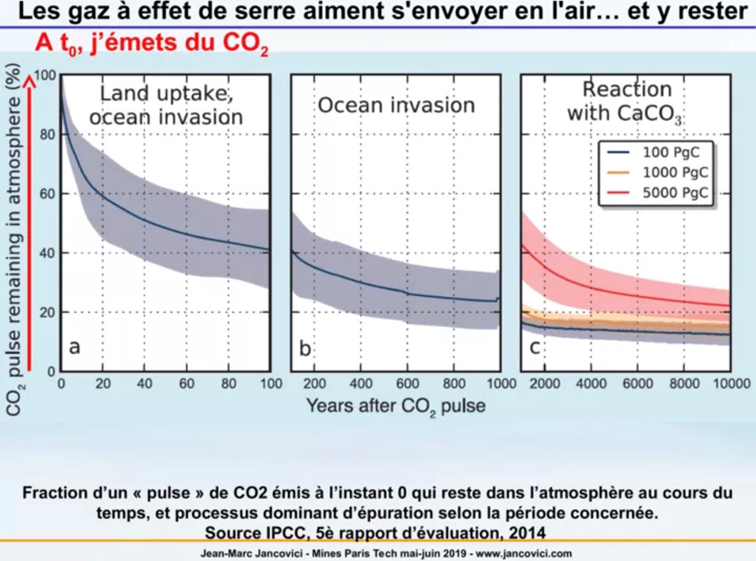
Avant de commencer partons d’un constat : si on arrêtait d’émettre du CO2 dans l’atmosphère aujourd’hui, dans 10000 ans il en resterait encore 10%. (merci à @Aubl_Bru de me l'avoir retrouvé et à @valmasdel et @fmbreon pour leurs sources sur le sujet) 2/n
Dans la même veine, une molécule de CO2 émise aujourd’hui aurait un temps de résidence moyen dans l’atmosphère de 100 ans vs 12 pour du méthane CH4. Pourquoi une telle différence ? Pourquoi un tel délai ? 3/n
Je vais vous faire part ici de ce que j'ai assimilé et compris du sujet en cherchant. Evidemment toute correction et/ou ajout sont les bienvenus :) 4/n
Pour amener des éléments de réponses (non exhaustifs) à cette question nous allons devoir parler
1- De la structure des atomes
2- De la nature des liaisons chimiques
3- De comment on casse une liaison chimique
Vaste, programme. Mais on va y arriver ! 5/n
1- De la structure des atomes
2- De la nature des liaisons chimiques
3- De comment on casse une liaison chimique
Vaste, programme. Mais on va y arriver ! 5/n
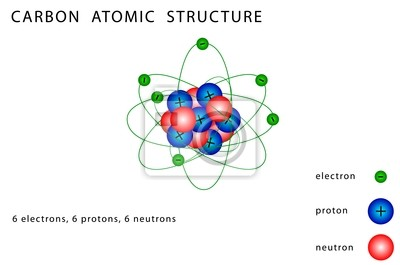
1-La structure des atomes. Partons des bases, rappelons qu’un atome c’est un noyau composé de protons et de neutrons autour duquel gravite des électrons (ou e-) 6/n
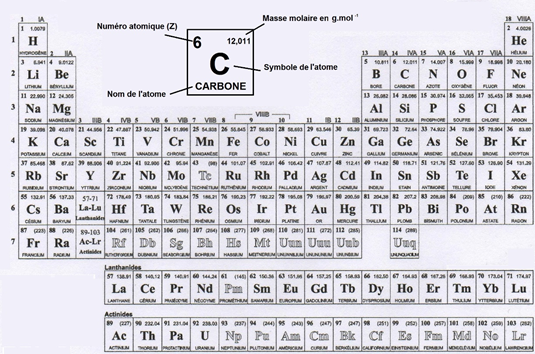
Le nombre de protons caractérise chaque élément : 1 proton pour l’hydrogène, 2 pour l’Hélium, 3 pour le lithium… 6 pour le carbone, 8 pour l’oxygène, 92 pour l'uranium. On appelle ce nombre le n° atomique qu'on retrouve facilement sur la table de Mendeleïev. 7/n
Dans un atome le nombre de proton est égal au nombre d’e- L’hydrogène en a 1, le carbone 6, l’oxygène 8.
Le nb de neutrons donne l’isotope, la «version». Protons + Neutrons = le nb de masse. Ex: le Carbone 12 possède 6 protons plus 6 neutrons, le C14 6 protons et 8 neutrons 8/n
Le nb de neutrons donne l’isotope, la «version». Protons + Neutrons = le nb de masse. Ex: le Carbone 12 possède 6 protons plus 6 neutrons, le C14 6 protons et 8 neutrons 8/n
Voici l'exemple détaillé du Carbone (C) 12, le plus courant: 6 protons, 6 neutrons et 6 électrons.
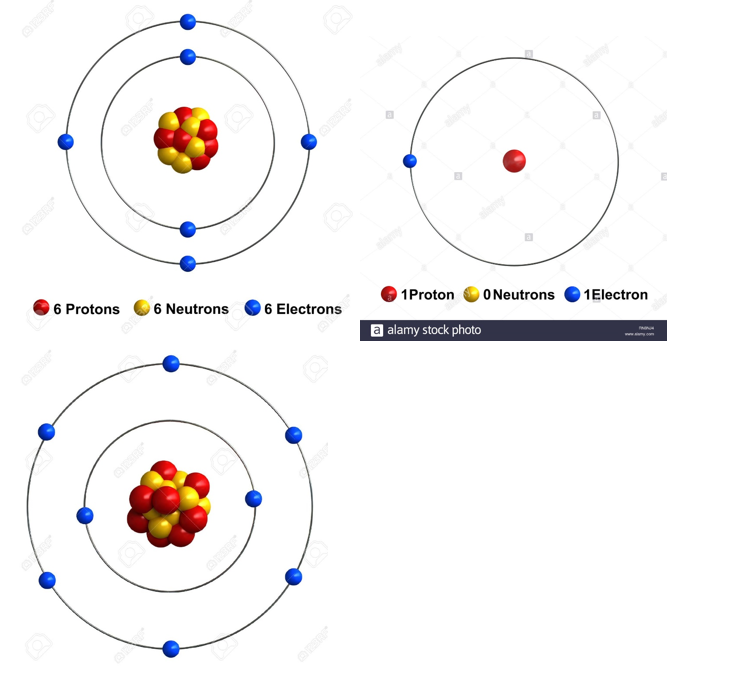
Mais neutrons et protons ne nous intéressent pas ici. On ne va s’intéresser qu’aux e-: ils ne sont pas disposés n’importe comment dans un atome, ils sont disposés en couche 9/n
Mais neutrons et protons ne nous intéressent pas ici. On ne va s’intéresser qu’aux e-: ils ne sont pas disposés n’importe comment dans un atome, ils sont disposés en couche 9/n
2-Nature des liaisons chimiques.
Point important: La première couche a 2 e- maximum, les 2 suivantes 8 (on ne s’intéressera pas aux autres ici)
C'est la saturation de ces couches électroniques qui vont déterminer le nombre de liaisons que va pouvoir faire un atome. 10/n
Point important: La première couche a 2 e- maximum, les 2 suivantes 8 (on ne s’intéressera pas aux autres ici)
C'est la saturation de ces couches électroniques qui vont déterminer le nombre de liaisons que va pouvoir faire un atome. 10/n
En effet le but du jeu pour un atome et de remplir ses couches électroniques donc d’avoir 2 e- dans sa première couche pour l’hydrogène, 8 dans sa 2e couche pour le carbone et l’oxygène qui nous intéressent ici 11/n
On parle des règles du duet (pour les 2e- de la première couche) et de l’octet (pour les 8 des 2 couches d'après). Les atomes tendent vers le respect de ces règles pour des raisons de stabilité. Leur non-respect donne des éléments instables. 12/n
NDLR: Pour la suite on notera l'hydrogène H, l'oxygène O, le carbone C et on ne représentera que la dernière couche d'e- dans un soucis de simplification et de lisibilité 13/n
Prenons les exemples du C à gauche, de l'H à droite et de l’O en bas que voici.
Pour H vous constaterez qu’il manque 1 e- à H pour saturer sa première couche, pour C il manque 4 e- (ou il y en a 4 en trop) et pour O il manque 2 e- (ou il y en a 6 en trop) 14/n
Pour H vous constaterez qu’il manque 1 e- à H pour saturer sa première couche, pour C il manque 4 e- (ou il y en a 4 en trop) et pour O il manque 2 e- (ou il y en a 6 en trop) 14/n
Bon clairement pour l’O, virer 6 e- ça va pas être gérable. Du coup il va plutôt essayer d’en choper 2. 15/n
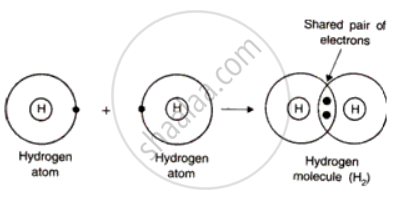
Comment diable ces atomes vont-ils faire pour récupérer ou refiler les e- ? Eh ben ils vont se les « prêter » en se liant. L’H va par exemple se combiner avec un autre H, chacun ayant 1 e-. Du coup on obtient 2 H ayant 2 e-. 16/n
NDLR2 : Vu qu’ils mettent leurs e- en commun on peut dire que les atomes sont communistes 17/n
Les 2 e- vont être « à la fois » dans la première couche du premier H mais aussi du 2e liant ces 2 atomes entre eux. Une liaison de ce type, dite covalente, est donc un « partage » d’un duo, ou doublet, d’e- 18/n
Le C va faire pareil mais lui a 4 e- à partager donc va pouvoir se lier 4 fois. L’O lui va partager 2 e- pour en faire 2 doublets. Ainsi C et O finissent donc bien à 8 19/n
Voici ce que cette logique donne avec le méthane CH4 ou on a 1C + 4H = CH4 . Chaque hydrogène a donc bien 2 e- sur sa couche externe et le C a bien 8 e-. Tout le monde est content 20/n
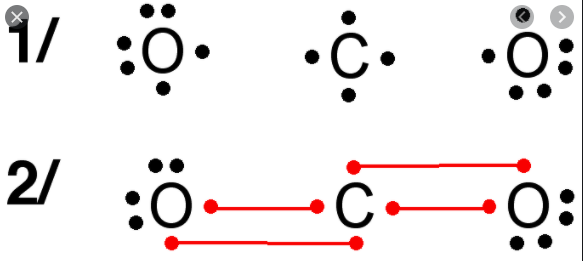
Pour le CO2 on a 1C + 2O = CO2. Chaque O prête 2 e- au C et le C prête 2 e- à chaque O. Tout le monde fini à 8 et est donc content 21/n
3- Quid des ruptures ? « Les liaisons covalentes c’est comme les histoires d’amour, plus les amants sont proches plus il faut mettre d’énergie pour les séparer » aurait dit un jour un grand Homme (ou Gérard au PMU je ne sais plus trop) 22/n
Ainsi plus nos atomes liés sont proches (au premier ordre), proximité qui dépend en outre des couches électroniques d’où proviennent les e- de la liaison, plus il est difficile de rompre ces liaisons 23/n
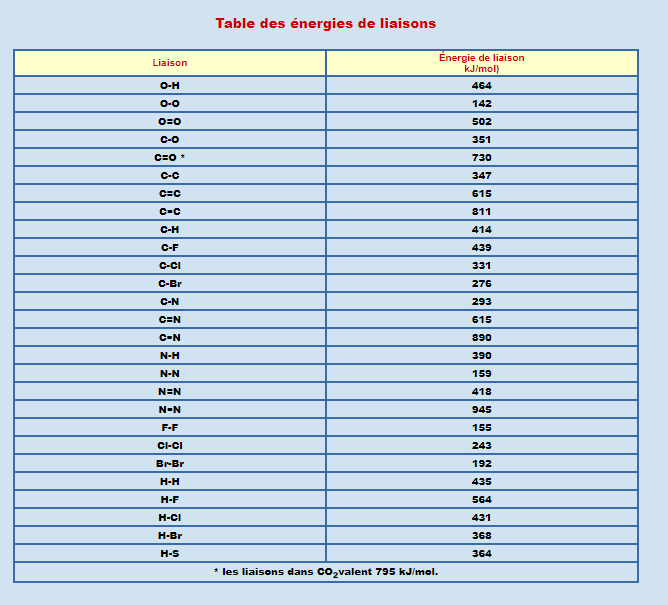
L’air contient majoritairement des atomes de C,H,O,N sous forme de diazote N2, du dioxygène O2, du CO2, du CH4 et de l’eau H2O. Pour savoir si on peut avoir spontanément une réaction entre ces composants il faut connaitre l’énergie des liaisons de ces composés 24/n
N2 réagit peu ou pas car les 2 atomes d’azote N ont besoin d’un énorme apport d’énergie pour se dissocier, cette énergie provient parfois des orages, parfois se fait dans des bactéries grâce à leur métabolisme (poke @DurocYann). On le néglige donc 25/n
Reste H2O, CO2, CH4 et O2. L’idée est donc d’écrire une réaction entre ces 4 composés genre 2O2 + CH4 = CO2 + 2H2O. On calcule les énergies des toutes les liaisons pour les 2 côtés de l’égalité 26/n
Puis on fait la soustraction de ces 2 calculs, si le résultat est négatif (plus d’énergie à droite qu’à gauche) alors la réaction se fait spontanément et libère de l’énergie. Sinon il faut lui en apporter pour qu’elle ait lieu. 27/n
La réaction que j’ai écrit 2 tweets plus haut est spontanée. On peut donc la réécrire ainsi 2O2 + CH4 = CO2 + 2H2O + énergie. Notez que l’égalité peut se lire dans les 2 sens donc… 28/n
Si on fait ce même raisonnement avec les différents composés de l’air et qu’on teste les réactions possibles, on aura toujours le cas où la formation de CO2 amène à la libération d’énergie donc se fait spontanément 29/n
NDLR3: Je vous laisse vérifier par vous même et vous amuser à tester les combinaisons favorables ou non. Dans ma réaction on a 4 liaisons C-H et 2 liaisons doubles O=O d'un coté et 2 doubles liaisons C=O et 4 liaisons H-O de l'autre 30/n
Réciproquement donc, il faut donc amener de l’énergie au système pour casser le CO2. En effet on peut lire l’égalité dans les 2 sens et l’écrire ainsi CO2 + 2H2O + énergie = 2O2 + CH4 là est tout le problème… 31/n
4-Conclusion : le CO2 est une molécule ou un carbone se lie 2 fois à 2 oxygènes via un partage d’électrons. Ces atomes d’O ont pour particularité d’être très collant avec C et de ne pouvoir s’en séparer sans apport d’énergie dans l’air 32/n
C et H sont moins collants, donc lorsqu’ils forment du CH4 on peut espérer les séparer sans énergie supplémentaire si on forme du CO2 au final dans les conditions atmosphériques encore une fois. 33/n
C’est pour ça qu’éliminer du CO2 de l’atmosphère se fait méga lentement par rapport au CH4 : il n’y a pas de réaction libérant de l’énergie à partir du CO2, alors que c’est le cas à partir du CH4 34/n
C’est aussi en partie pour ça qu’on dit que sur 1 siècle le CH4 a un pouvoir réchauffant > à celui du CO2 mais sur 1000 ans c’est moins vrai : en 1000 ans votre méthane aura dégagé depuis belle lurette donc ne réchauffera plus rien 35/n
C’est aussi en partie pour ça que retirer du CO2 de l’atmosphère par géoingénérie c’est chaud car il faut très souvent apporter de l’énergie pour casser ce CO2 36/n
Merci et bravo à vous d’être arrivé jusque-là. Le moins que l’on puisse dire c’est que c’était dense. J’espère avoir été clair. RT permet d’amener de l’énergie afin de transformer du CO2 en autre chose de moins réchauffant. 37/37 #Fin
P.S : Péter du CO2 la nature sait faire, ça s’appelle la photosynthèse qui est une suite de réactions il y a apport d’énergie via le soleil pour casser le CO2 pour former de l’O2 et de la matière organique. 38/37
On peut écrire ça comme ça CO2 + H2O + énergie = O2 + matière organique. Matière organique qui entre ensuite dans la chaine alimentaire 39/37
Cette énergie chimique est récupérée par le vivant pour fonctionner ensuite. Dans le cas général il se passe ça O2 + matière organique = CO2 + énergie. Nous fonctionnons donc grâce à de l’énergie solaire stockée chimiquement 40/37
Le rêve de @PaulNau @Greenpeace @EELV : le vivant marche à l’énergie renouvelable (solaire essentiellement) et pour palier à l’intermittence la stocke sous forme chimique comme une batterie le fait 41/37
Je n’entre pas dans le détail ce sera peut-être l’objet d’un autre thread. On a vu assez de trucs compliqués pour aujourd’hui. Ce sera pour une autre fois la thermodynamique et le métabolisme des cellules ^^ 42/37

 Read on Twitter
Read on Twitter